Krankheitserreger ohne eigenes Erbgut gibt es nicht. Dachte man. Seit 40 Jahren ist man schlauer. Denn Prionen sind einzelne Proteinmoleküle und sie funktionieren ohne eigenes Erbgut. Sie lösen tödliche Krankheiten des Nervensystems aus, z.B. Rinderwahnsinn oder die Creutzfeld-Jacob-Erkrankung.
Der Wissenschaftler Stanley Prusiner enttarnte diese sehr speziellen Krankheitserreger. Dennoch wurde er lange Zeit nicht ernst genommen und musste gegen massive Widerstände ankämpfen. Im BiOfunk folgen wir den verschlungenen Wege, die zur Entdeckung der Prionen führten.
Die Creuzfeld-Jacob-Erkrankung ist eine sehr seltene Erkrankung des Nervensystems. Dabei kommt es zu einer schrittweisen Zersetzung des Gehirns. Es bilden sich Löcher im Hirngewebe, das führt zu einer schwammartigen Struktur. Die Krankheit endet immer tödlich. Eng verwandt mit der Creutzfeld-Jacob-Erkrankung ist Kuru, eine Krankheit die bei einem indonesischen Volksstamm auftritt. Und dann gibt es noch Scrapie. Diese Krankheit befällt Schafe und auch hier wird das Gehirn durchlöchert bis sich eine schwammartige Struktur bildet. Auch diese Krankheit endet immer tödlich. Doch wodurch werden diese Krankheiten ausgelöst?
Stanley Prusiner (Abb. 1) wollte das Rätsel lösen und den Krankheitserreger identifizieren. Konkret untersuchte er die Scrapie-Erkrankung, die bei Schafen auftritt. Um den Krankheitserreger zur identifizieren, benötigte man zunächst größere Mengen davon. Deshalb reicherten Prusiner und seine Mitarbeiter den unbekannten Erreger durch eine Reihe biochemischer Verfahren im infektiösen Material an. Nach jahrelanger Forschung hatten sie eine konzentrierte Lösung des Erregers und versuchten herauszufinden, was es nun eigentlich war.
Basierend auf seinen Ergebnissen entwickelte Prusiner seine Prionen-Hypothese. Demnach waren die Erreger der Scrapie-Erkrankung Proteine und keine Viren. Schließlich konnte Prusiner tatsächlich die Prion-Proteine isolieren. Und er konnte zeigen, dass sie die Krankheit auslösen.
Das Prionprotein kann in zwei unterschiedlichen Formen vorkommen. In der Regel liegt es in den Nervenzellen in seiner ungefährlichen Form vor. Doch in seltenen Fällen faltet es sich anders. Es nimmt sozusagen eine gefährliche Form an. Und das falsch gefaltete Prion bleibt nicht allein. Es dockt an die normal gefalteten Prionen an. Daraufhin verändern diese ihre Form und sind auch falsch gefaltet. Es kommt zu einer Kettenreaktion (Abb. 2). Die ungefährlichen Prionproteine werden umgedreht und dadurch zu gefährlichen Prionen. Und diese drehen andere Prionproteine um und so weiter. Die falsch gefalteten Prionen klumpen zusammen und bilden unlösliche Ablagerungen, sogenannte Amyloid-Plaque. Und schließlich sterben die betroffenen Nervenzellen ab. So werden Stück für Stück bestimmte Gehirnbereiche zerstört, übrig bleibt durchlöchertes, schwammartiges Hirngewebe. Und schließlich stirbt der betroffene Mensch oder das Tier.
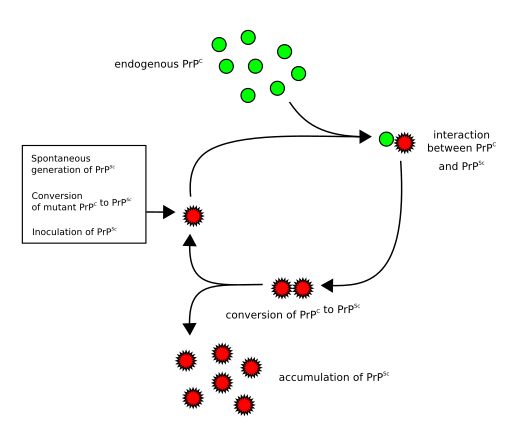
Abb. 2: Kettenraktion bei Prion-Erkrankungen – Normal gefaltetes Prionprotein PrPc (grüne Farbe) verändert nach Kontakt mit falsch gefaltetetem Prionprotein PrPsc (rote Farbe) seine Form und wird ebenfalls zu krankhaftem PrPsc.
Weitere Informationen
spektrum.de: 30 Jahre Prionen – Ein Blick zurück nach vorn
Pathogens and Disease: A brief history of prions
Stanley Pruisner and the Discovery of Prions: Infectious Agents Comprised Entirely of Protein
Buchtipp: „Madness and Memory“ von Stanley Prusiner

